14 - Programme de formation : passage à la version 2016 de l'ISO 13485
OBJECTIFS
- Comprendre et mettre en oeuvre les exigences applicables à l'ISO 13485 :2016
PUBLIC
- Fabricants de dispositifs médicaux/Sous-traitants impliqués dans le cycle de vie du dispositif médical.
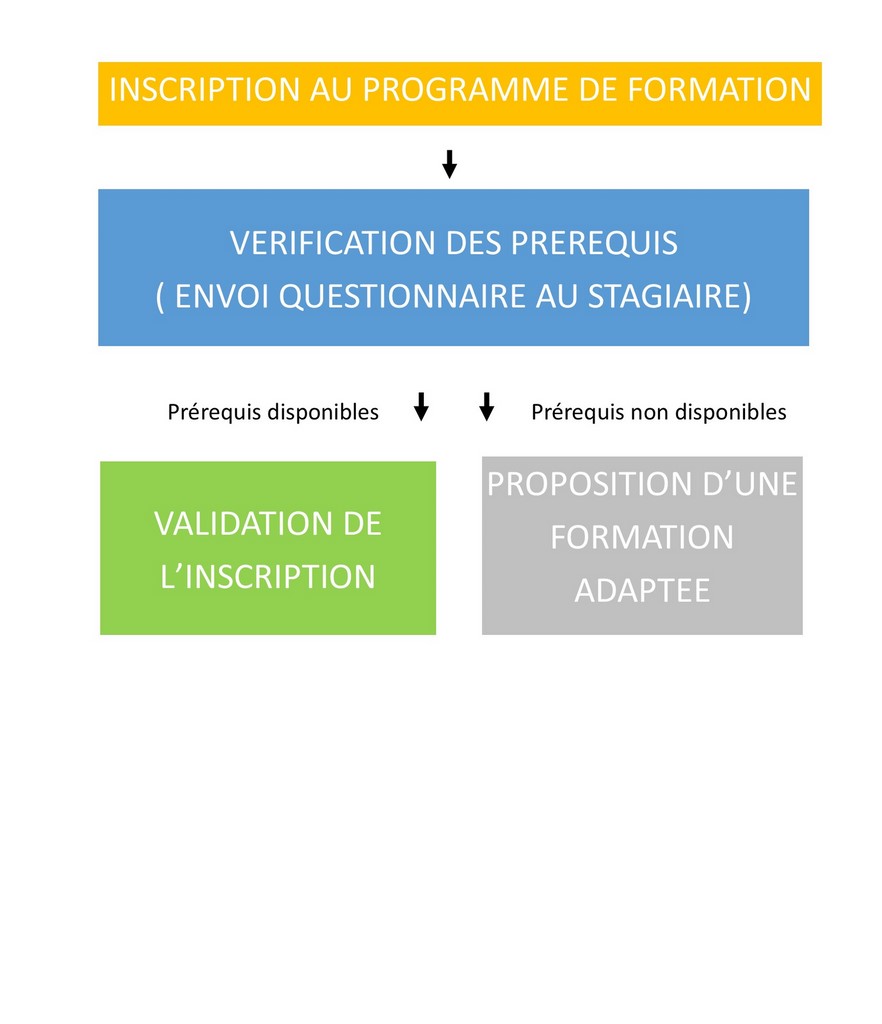
PRE-REQUIS
- Connaisance ISO 13485 ancienne version.
CONTENU
Présentation générale de la norme ISO 13485
- Pourquoi l'ISO 13485 : version 2016.
- Clarification des principes de la norme ISO 13485 :2016.
- Les nouveautés sur les termes et définitions.
Etude des exigences spécifiques des évolutions de l' ISO 13485
- Le domaine d'application.
- Les exigences réglementaires applicables.
- Gestion des risques.
- Maîtrise de la documentation et des enregistrements.
- Maîtrise des infrastructures.
- Maîtrise de la conception et du développement.
- Maîtrise des achats.
- Maîtrise de la contamination.
- Le traitement des réclamations par rapport aux autorités réglementaires.
Mise à niveau de votre système de management de la qualité selon la nouvelle version ISO 13485
- Identifier les modifications à prévoir dans la mise en oeuvre du système de management de la qualité.
- Documents et enregistrements obligatoires.
- Evaluer le niveau de gestion des risques.
MOYENS PEDAGOGIQUES, TECHNIQUES ET D'ENCADREMENT
La formation s'appuie sur :
- Un travail sur des cas pratiques et des mises en situations.
- Des exercices d’applications.
- La mise à disposition des supports de formation.
La formation est assurée par un intervenant disposant des compétences théoriques et pratiques dans la mise en oeuvre d'un système de management de la qualité ISO 13485 :2016 dans le cadre de son activité professionnelle.
SUIVI ET EVALUATION
La formation fait l'objet :
- D'une feuille de présence émargées par les stagiaires.
- D'une évaluation de chaque stagiaire à travers une fiche d'évaluation sous forme de QCM et de questions ouvertes.
- D'un certificat de formation délivré à chaque stagiaire.