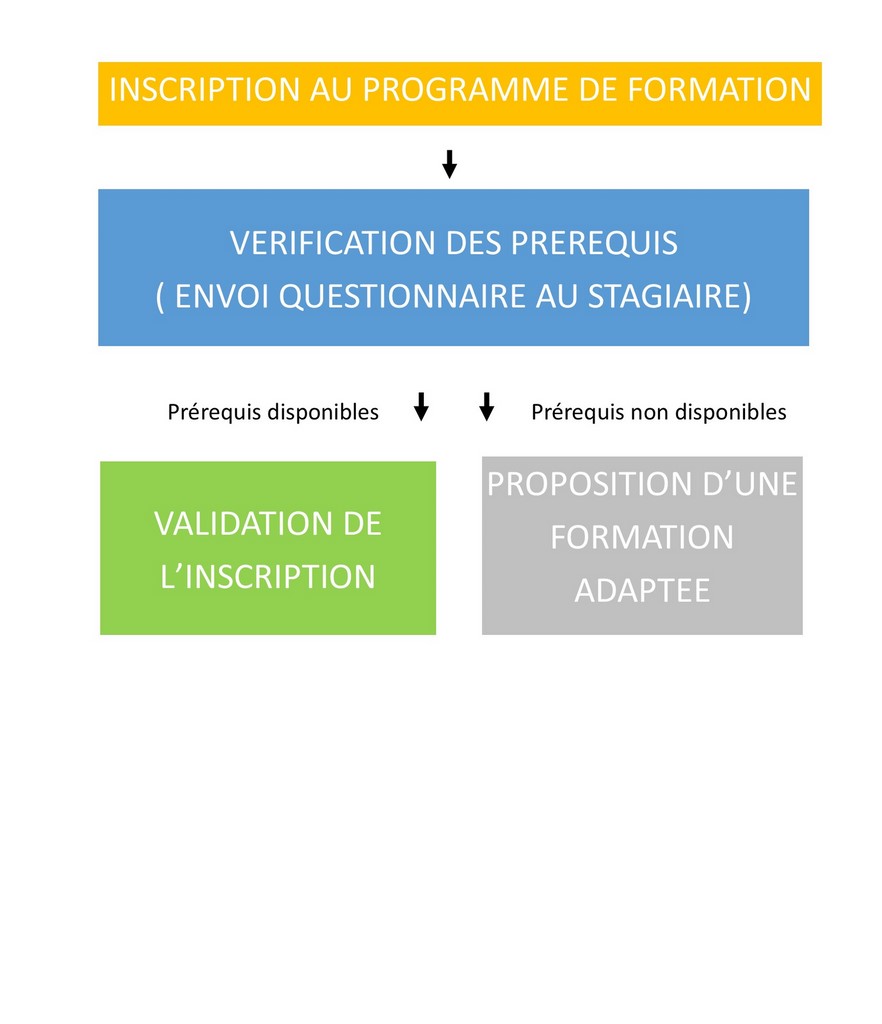
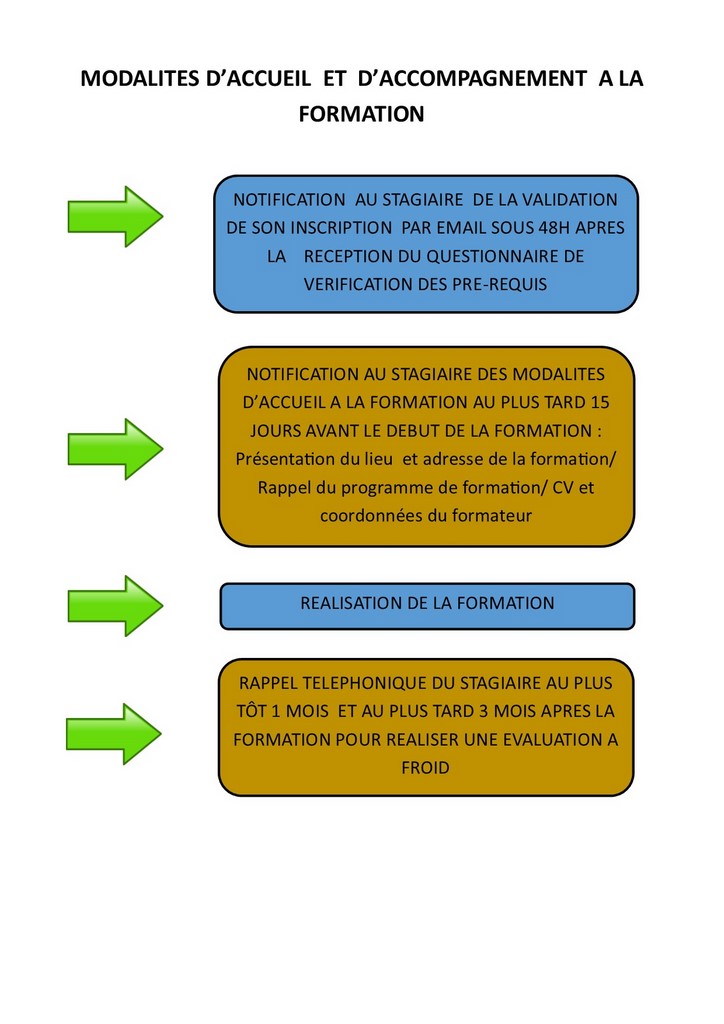
17 - ISO 14971 : la gestion des risques pour les dispositifs médicaux
OBJECTIFS
- Comprendre et mettre en oeuvre la gestion des risques sur les dispositifs médicaux.
PUBLIC
- Fabricants de dispositifs médicaux/Sous-traitants impliqués dans le cycle de vie du dispositif médical.
PRE-REQUIS
- Connaissance des directives 90/385/CEE ou 93/42/CEE.
- Connaissance du référentiel ISO 13845.
CONTENU
Gestion des risques
- Processus de gestion des risques.
- Plan de gestion des risques.
- Dossier de gestion des risques.
Analyse des risques
- Procédure d'analyse des risques.
- Emploi prévu/destination prévue du dispositif et identification des caractéristiques relatives à la sécurité du dispositif médical.
- Identification des phénomènes dangereux connus et prévisibles.
- Evaluation des risques pour chaque phénomène dangereux.
Evaluation des risques
Maîtrise des risques
- Réduction des risques.
- Analyse des options.
- Mise en œuvre de la mesure de maîtrise du risque.
- Evaluation des risques résiduels.
- Analyse du rapport bénéfice/risque.
- Autres phénomènes dangereux générés.
- Evaluation complète des risques.
- Evaluation de l'ensemble des risques résiduels.
- Rapport de gestion des risques.
- Informations postproduction.
MOYENS PEDAGOGIQUES, TECHNIQUES ET D'ENCADREMENT
La formation s'appuie sur :
- Un travail sur des cas pratiques et des mises en situations.
- Des exercices d’applications.
- La mise à disposition des supports de formation.
La formation est assurée par un intervenant disposant des compétences théoriques et pratiques dans la mise sur le marché d'un dispositif médical.
SUIVI ET EVALUATION
La formation fait l'objet :
- D'une feuille de présence émargées par les stagiaires.
- D'une évaluation de chaque stagiaire à travers une fiche d'évaluation sous forme de QCM et de questions ouvertes.
- D'un certificat de formation délivré à chaque stagiaire.